重磅!四大修订要点一览——2024版《特殊医学用途配方食品通则》(征求意见稿)
2024/1/23 11:14:02

2024年1月18日,食品安全国家标准审评委员会秘书处发布《特殊医学用途配方食品通则》征求意见稿,征求时间为2024年1月18日至2024年2月29日。结合征求意见稿及编制说明,整理了《特殊医学用途配方食品通则》征求意见稿的修订要点,以供企业了解。
相比于GB 29922-2013版,修订意见稿主要围绕产品类别、技术要求、标签标识和其他要求四大方面进行修订,详情如下:
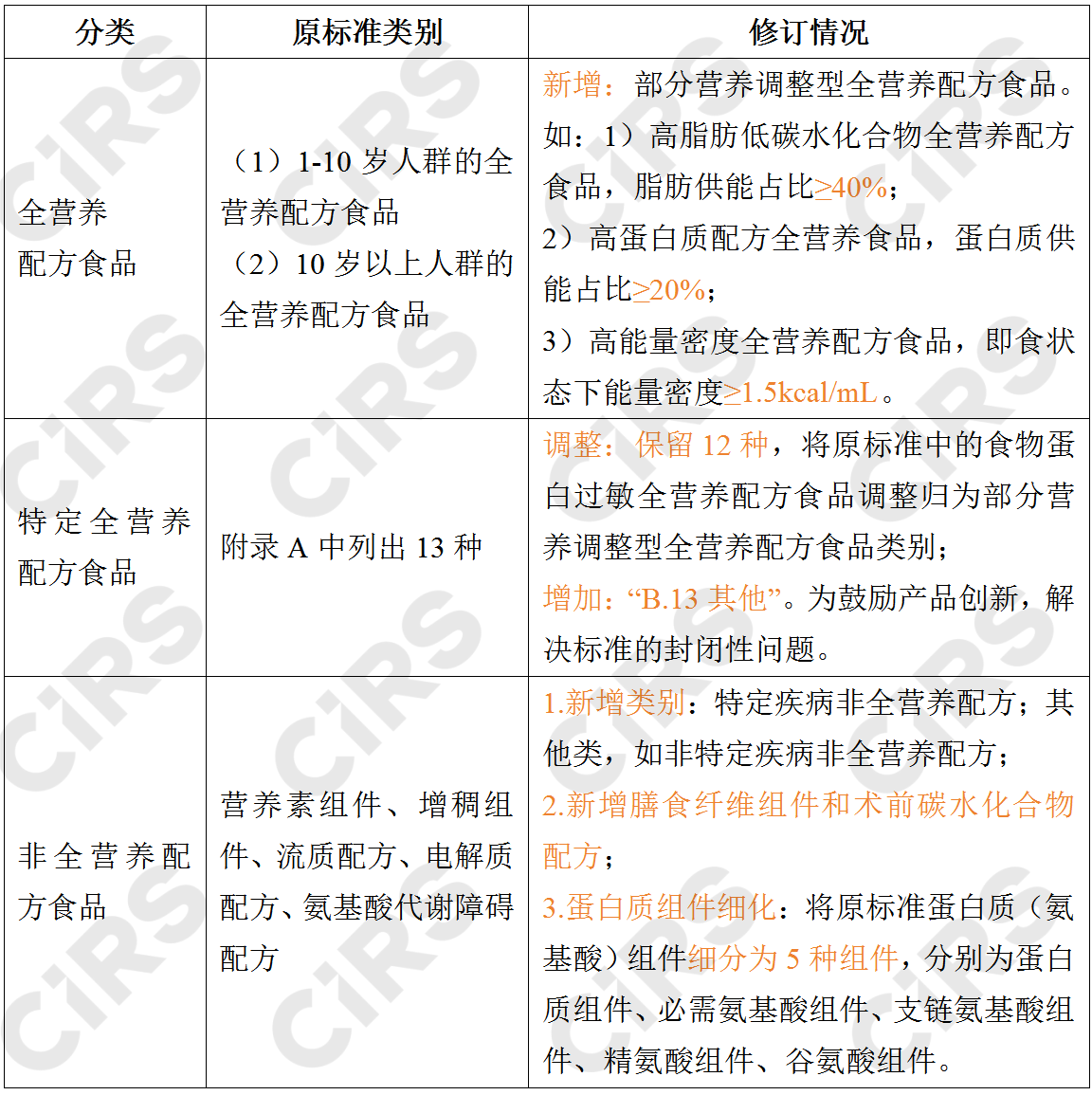
01产品类别的修订
表1 特殊医学用途配方食品的产品类别修订情况
02技术要求的修订
技术要求修订,是在原有技术要求方面进行细化、更细和补充,同时对部分营养素含量要求进行微调。详情见下表:
表2 特殊医学用途配方食品营养成分技术要求的修订情况

03
标签标识的修订
- 增加膳食纤维标识的要求,并标示其种类(可溶/不可溶);
- 增加增稠组件产品冲调使用后技术指标方面的标示要求。冲调后对应的吞咽障碍食品分级及冲调温度、放置时间等参数;
- 增加部分产品中渗透压的标识要求。流质配方、电解质配方、术前碳水化合物配方、氨基酸代谢障碍配方产品应标示产品即食状态的渗透压。其他产品根据情况可选择标示。
04
其他要求修订
- 增加对特定全营养配方食品的管理要求:明确特定全营养配方食品是在全营养配方食品不能满足目标人群营养需求时,才需要制定标准或营养配方,明确未制定国标的特定全营养配方食品,其安全性与应用效果需经科学证实。
- 增加了半固态特医食品微生物限量要求,应与液态一致,达到商业无菌。
- 进一步明确香精香料在特医食品中的使用规定。适宜人群为1~3岁,则必须符合GB 2760关于较大婴儿和幼儿配方食品中香料的使用规定,如果适用人群不包括1~3岁,则可使用GB 2760中规定的食用香精香料。
来源 | CIRS食品合规互动

