【重要进展】协同作用和氧气适应开发下一代益生菌

人类肠道微生物群作为可能导致健康或疾病的环境因素而引起研究者的兴趣。开发下一代益生菌是调节肠道微生物群和改善人类健康的一种有前途的策略;然而,几种关键的候选下一代益生菌是严格厌氧的,可能需要与其他细菌协同作用才能实现最佳生长。普拉氏栖粪杆菌(Faecalibacterium prausnitzii)是一种常见且丰富的人类肠道细菌,与人类健康相关但尚未开发成益生菌制剂。本文描述了普拉氏栖粪杆菌和猪脱硫弧菌(Desulfovibrio piger)(一种硫酸盐还原菌)的共同分离,以及它们的交叉喂养以促进生长和丁酸盐生产。为了生产下一代益生菌配方,本文使普拉梭菌适应氧气暴露,并且在概念验证研究中,证明了小鼠和人类都可以耐受该共生产品,并且能够在一部分研究参与的人类肠道中检测到。本文研究描述了一种生产下一代益生菌的技术,该技术基于严格厌氧细菌的适应性,使其能够耐受氧气暴露而不减少其潜在的有益特性。因此本文的技术可用于开发其他严格厌氧菌株作为下一代益生菌。
普拉氏栖粪杆菌与猪脱硫弧菌的分离与验证
为了保持微生物与微生物的相互作用,并分离能够充当电子接受者的细菌,以及去除乳酸,本文在厌氧条件下将健康个体的粪便直接铺在 Postgate 培养基 (PGM) 的琼脂平板上。普拉氏栖粪杆菌(Faecalibacterium prausnitzii)(DSM32186)菌株,该菌株在 PGM 中与猪脱硫弧菌(Desulfovibrio piger)(DSM 32187) 共生长。猪脱硫弧菌是专性厌氧、非发酵、革兰氏阴性杆菌,是人类肠道中常见的硫酸盐还原剂,不会在肠道外孤立存在,因此被认为是肠道特异性共生菌。
为了确认分离株的身份,本文对它们的基因组进行了测序,并观察到 猪脱硫弧菌DSM 32187 与其他已测序的 猪脱硫弧菌菌株聚类在一起,而普拉氏栖粪杆菌DSM 32186 与 普拉氏栖粪杆菌系统群 II 聚类在一起,包括普拉氏栖粪杆菌菌株 A2-165 。基因组分析表明,这两种分离株在系统发育树中形成了特定的进化枝,表明它们代表了以前未表征的菌株。由于 A2-165 具有抗炎特性并且可以在粘膜界面相互作用,因此本文通过评估 DSM 32186 与 A2-165 相比的免疫调节特性,验证了 DSM 32186 的益生菌潜力。当将不同普拉梭菌菌株的上清液应用于 Caco-2 细胞时,观察到白细胞介素 1β (IL-1β) 诱导的 IL-8 分泌出现类似的减少,从而在表型水平上证实了与 A2-165 的相关性。
本文假设 PGM 中普拉氏栖粪杆菌和猪脱硫弧菌的共分离以及它们假定的共生关系是由于互补的代谢需求所致。为了验证这一假设,在含有葡萄糖的,以支持普拉氏栖粪杆菌生长的改良 PGM 培养基中共培养这两种菌株,并观察到与同一培养基中的单一培养相比,共培养中普拉氏栖粪杆菌的生长显着增加。生长 24 小时后条件培养基中的代谢物分析表明,正如预期的那样,猪脱硫弧菌的单一培养物消耗乳酸并产生乙酸,而不消耗葡萄糖,而 普拉氏栖粪杆菌的单一培养物产生非常少量的乳酸。然而,普拉氏栖粪杆菌与猪脱硫弧菌的共培养促进了葡萄糖的发酵以及乳酸和丁酸的产生。普拉氏栖粪杆菌通过丁酰辅酶 A (CoA):乙酸 CoA 转移酶途径产生丁酸,因此,乙酸盐不会在共培养物中积累在培养基中,因为丁酸生产需要乙酸盐。因此,本文的研究结果表明,猪脱硫弧菌在 PGM 共培养物中充当电子接收者,因为它消耗乳酸;猪脱硫弧菌产生的乙酸盐被普拉氏栖粪杆菌用于生长和丁酸盐生产。
普拉氏栖粪杆菌的耐氧性调整及其与猪脱硫弧菌的共培养
由于人类肠道细菌对氧敏感,下一代益生菌的产品开发具有挑战性。该过程还需要优化生长条件以获得足够的生物质(biomass)产量,以及保持最终产品活力的新策略。使用 普拉氏栖粪杆菌与 猪脱硫弧菌的共培养来提高发酵中的生长产量。然而,由于普拉氏栖粪杆菌对环境空气中的氧气极其敏感,当普拉氏栖粪杆菌DSM 32186 暴露在空气中20 分钟时无法继续或回复生长。相比之下,猪脱硫弧菌在相同条件下相对耐氧。
如前所述,含有普拉氏栖粪杆菌的制剂的保质期可以通过使用半胱氨酸等抗氧化剂来延长,但其工业规模生产的适用性有限,因为暴露于环境空气 24 小时后普拉氏栖粪杆菌的活力就会丧失。为了提高 普拉氏栖粪杆菌的氧耐受性,本文采用了使用 m-SHIRM (modified simulated human redox intestinal model )生物反应器的适应策略,其中 DSM 32186 暴露于氧化条件下连续十个传代培养步骤,同时降低半胱氨酸浓度并增加阳极电位。在每个步骤中,将上一步的样品在厌氧条件下接种到酵母提取物酪酮脂肪酸葡萄糖 (YCFAG) 生长培养基上。培养基平板的目视检查显示出第六次和第十次传代培养时不同的菌落形态类型,并通过 16S rRNA 基因测序分类确认为普拉氏栖粪杆菌后,选择了 5 个菌落形态类型用于表征耐氧性。两种形态类型(DSM 32378 和 DSM 32379)清楚地观察到耐氧性增加,并且在丁酸生产能力没有损失的情况下发生。DSM 32379 的耐氧性增加最高,猪脱硫弧菌DSM 32187 进行协同生长分析,猪脱硫弧菌DSM 32187 的生长也未受影响。
因此,由于耐氧性以及与 猪脱硫弧菌的共培养,能够生产足够量的 普拉氏栖粪杆菌供人类使用:耐氧性的普拉氏栖粪杆菌 DSM 32379 可以冷冻干燥,并满足 2 周的-20°C 条件下的保存稳定性标准,可开发成减少活力损失的胶囊(储存两周之前和之后的 log10 CFU g-1= 为9.6 和 9.5)。相比之下,亲本菌株 DSM 32186 只能产生较低的生物量 (log10(CFU g−1) = 8.5),并且活力损失了 97%。
耐氧性增加的普拉氏栖粪杆菌在小鼠体内安全性试验
为了描述导致耐氧性增加的可能分子机制,本文对 DSM 32379 进行了基因组测序,结果揭示了 10 个基因座(loci)中的 15 个变异,影响 23 个核苷酸(占总基因组的 0.0007%)。这些变异发生在具有已知和未知功能的基因中,但由于分子生物学方法无法对 DSM 32186 进行基因层面上的修饰,因此无法验证这些变异在耐氧性发展中的作用,因此分子机制仍然未知。然而,DSM 32379 中的氧耐受性并没有改变其免疫调节特性,并且 DSM 32379 保留了之前在普拉氏栖粪杆菌A2-165 中表征的核黄素依赖性细胞外电子穿梭的能力。这些结果表明 DSM 32379 中的氧耐受性不会改变细胞生理学、代谢以及其在粘膜界面与宿主相互作用的潜力,因此可以选择该变种用于生产研究产品。
接下来,本文通过给瑞士韦伯斯特(Swiss Webster)雄性和雌性小鼠灌胃含有 普拉氏栖粪杆菌DSM 32379 和猪脱硫弧菌DSM 32187 的细菌悬浮液来评估组合产品的安全性。小鼠在第一周内接受的剂量为1010 CFU/菌株,接种 5 次然后从第二周开始每周两次,持续三周。本文没有观察到不良反应。通过定量 PCR (qPCR) 评估了 普拉氏栖粪杆菌和 猪脱硫弧菌在小鼠盲肠中的水平,但在研究结束时没有观察到这两个物种的水平有所增加,这可能是由于给药的模式和频率以及普拉氏栖粪杆菌在结肠中的定位位置和/或宿主特异性。
耐氧性增加的普拉氏栖粪杆菌在人类体内的耐受性和安全性测试
为了调查细菌的耐受性,本文招募了 50 名 20-40 岁的健康男性和女性进行一项随机安慰剂对照研究,以补充低(1 × 108–5 × 108 CFU/胶囊)或高(1 × 109–5 × 109 CFU/胶囊)剂量的 普拉氏栖粪杆菌DSM 32379 和猪脱硫弧菌与安慰剂进行对比,持续 8 周。除年龄(低剂量组与安慰剂组相比较高)、丙氨酸转氨酶水平(低剂量组与安慰剂组相比较低)和碱性磷酸酶水平(高剂量组与安慰剂组相比较低)外,各组具有匹配的临床特征。无论剂量如何,研究产品均具有良好的耐受性。没有研究参与者因不良事件而终止研究,并且治疗组中不良事件或胃肠道症状的频率没有增加。任何血液生化次级测量点(包括肾功能、血细胞计数、肝酶、炎症标志物、血红蛋白、糖化血红蛋白或空腹血糖)在基线和八周之间的变化没有临床相关或统计学显着的组间差异。
本文进行了全基因组的宏基因组测序,以评估耐氧性调整后的普拉氏栖粪杆菌对人类肠道微生物群的可能影响。在基线或给药结束时,总体组成没有组间差异,并且与基线相比,在任何组中都没有观察到变化。然而,在接受高剂量的参与者中,在种水平评估的 猪脱硫弧菌测序读数数量有所增加 (P < 0.01),而种水平上的普拉氏栖粪杆菌的测序读数没有变化。本文使用基因组捕获来具体量化菌株,并观察到亲本普拉氏栖粪杆菌DSM 32186 和 猪脱硫弧菌DSM 32187 在基线时非常常见(分别为 43 株中的 43 株和 43 株中的 35 株)。与种水平上的结果一致,高剂量组中猪脱硫弧菌DSM 32187 的比例有所增加 (P = 0.051),特别是在基线相对丰度较低的组中 (小于 0.05%,P = 0.042),尽管仍处于安慰剂组结果范围内,和一年内多次采样的健康瑞典人所能观察到的范围内。普拉氏栖粪杆菌DSM 32186 的比例没有变化。与缺乏成分变化相一致的是,粪便 SCFA 的水平没有变化,并且尽管猪 脱硫弧菌有所增加,但粪便中硫化氢的水平并没有变化。这些结果表明,此益生菌制剂对宿主(即没有不良事件和胃肠道症状)和肠道微生物群(即没有成分和代谢变化)都是安全的。
基于人类粪便的宏基因组检验
普拉氏栖粪杆菌的总物种水平丰度范围在 3.4% 至 25.9% 之间(平均 13.2%),与美国相似年龄的健康个体以及瑞典和英国的老年健康个体观察到的范围相似 ,并且高于最近一项大型荟萃分析中的物种水平丰度,其中包括 7,907 个粪便宏基因组11(平均值 6.5 ± 7.6%)。因此,普拉氏栖粪杆菌的进一步增加可能受到生态位饱和的限制。然而,根据观察到的猪脱硫弧菌DSM 32187 的增加,本文假设这对其他丁酸盐生产者的丰度有影响,例如那些类似于普拉氏栖粪杆菌的,需要细胞外乙酸来生产丁酸盐的成员。本文量化了丁酸生产的末端基因,并观察到与所有个体的基线相比,丁酸生产潜力的变化和给药结束时猪脱硫弧菌DSM 32187 的变化呈显着正相关(Spearman's rho = 0.48,P = 0.001 )以及接受低剂量或高剂量的个体(Spearman rho = 0.49,P = 0.006)也是如此,但在安慰剂组中没有观察到这样的结果(Spearman rho = 0.39,P = 0.185)。这些结果与最近的一项研究一致,该研究显示脱硫弧菌与不同的丁酸盐生产者(例如栖粪杆菌属、罗斯氏菌属、颤螺菌属和粪球菌属)共存,并表明本文的益生菌配方可能能够支持人类肠道内复杂群落的整体丁酸盐生产潜力。这些结果还强调了基线和/或特定肠道微生物群配置对于基于微生物群的治疗策略的潜在重要性。
最后,本文尝试在粪便样本中检测 普拉氏栖粪杆菌DSM 32379。针对一种或多种遗传变异的 qPCR 检测无法有效区分,并且基因组捕获方法无法用于区分耐氧变异 的DSM 32379 与亲本 DSM 32186,因为这些方法只能检测全基因组相似性鉴定低于96%的独特菌株。DSM 32379 与 DSM 32186 具有 99.9993% 的同一性。因此,在给药结束时通过基因组捕获检测到的 普拉氏栖粪杆菌DSM 32186 计数可能代表内源性 DSM 32186 和与益生菌制剂一起施用的耐氧性DSM 32379的总和。为了追踪粪便样本中可能存在的 DSM 32379,本文检测了宏基因组数据中的特定遗传变异。在基线或安慰剂组的一些参与者中观察到很少的变异标记(例如变异 7),这与观察到的普拉氏栖粪杆菌的遗传可塑性一致,并且在试验结束时在低剂量组和高剂量组的一部分研究参与者中发现了其他变异和/或几种组合。粪便宏基因组中 DSM 32379 的低检出率可能是由于 DSM 32379 与亲本菌株之间的基因组同一性较高以及随后宏基因组数据中的覆盖范围不足造成的,并且可能受到基线时 DSM 32186 的高水平的影响,表明菌株肠腔内饱和的生态位。然而,由于普拉氏栖粪杆菌也存在于粘膜界面,因此粪便采样可能无法反映靠近粘膜的 DSM 32379 计数,而耐氧 DSM 32379 可能在粘膜附近具有竞争优势。因此,本文假设下一代益生菌可能能够增加普拉氏栖粪杆菌丰度较低的患者群体(例如 2 型糖尿病患者)和患有肠道炎症(例如炎症性肠病)的个体,观察结果证实,给予 普拉氏栖粪杆菌A2-165 可改善结肠炎,并能够部分恢复小鼠体内的微生物群 。
本文的研究有一些限制。由于纵向数据有限,本文尚未探索肠道微生物群对给药制剂的瞬时或个性化反应。此外,本文无法确定导致普拉氏栖粪杆菌耐氧性增加的分子机制。尽管如此,本文开发了一种基于本研究中分离的 猪脱硫弧菌之间互养相互作用的方法,该方法可以使得普拉氏栖粪杆菌的生长和体外丁酸盐产量的增加,并可能影响人类体内丁酸盐的生产潜力肠道。
结论与未来方向:
针对肠道微生物群在改善人类健康方面具有巨大潜力,过去二十年的宏基因组学研究已经确定了多种细菌,这些细菌可能是开发下一代益生菌的候选细菌。然而,由于宏基因组学调查中检测到的 70% 细菌物种缺乏可培养物种,因此在人类研究中很少评估潜在的候选细菌。例如,嗜粘蛋白-艾克曼菌(Akkermansia muciniphila) 和 十二指肠厌氧菌(Anaerobutyricum soehngenii) 作为单一物种或与其他形成孢子的细菌组合被发现对人类食用是安全的,初步数据表明它们对小鼠和人类的葡萄糖代谢具有积极影响。
人类肠道细菌作为下一代益生菌的发展面临的主要挑战是挑剔的生长要求(即对特定营养或条件的要求)和对氧气的敏感性。事实上,迄今为止被选为下一代益生菌的人类分离株的例子包括拟杆菌属和梭菌属菌株(例如脆弱拟杆菌Bacteroides fragilis和丁酸梭菌Clostridium butyricum),它们在肠道厌氧细菌中具有相对较高的耐氧性。有研究分离出脆弱拟杆菌的耐氧气变种,表明具有固有的耐氧性的肠道细菌在直接暴露于氧气时可能会增强耐氧性。这种方法不能应用于对氧极其敏感的细菌,例如普拉氏栖粪杆菌,但是可以使用本文描述的方法来靶向该细菌。
在供人类食用的益生菌制剂中尚未描述过诸如普拉氏栖粪杆菌等严格厌氧细菌的添加。由于高脂血症、糖尿病前期和2型糖尿病、非酒精性脂肪肝病和炎症性肠病患者中普拉氏栖粪杆菌的丰度较低,因此普拉氏栖粪杆菌作为下一代益生菌的生产引起了极大的兴趣。本文基于利用肠道微生物和改善耐氧性之间的现有协同作用,展示了如何将普拉氏栖粪杆菌开发为供人类食用的下一代益生菌。该技术可用于开发其他对氧极其敏感的细菌作为下一代益生菌,以针对这些细菌丰度减少的患者群体。
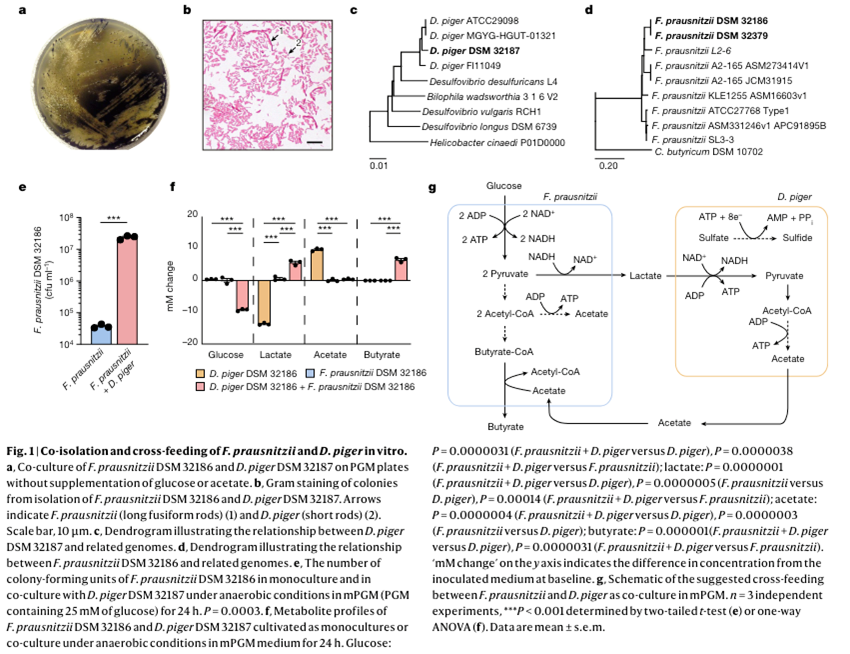
图1:普拉氏栖粪杆菌和猪脱硫弧菌在体外的共分离和交替喂养
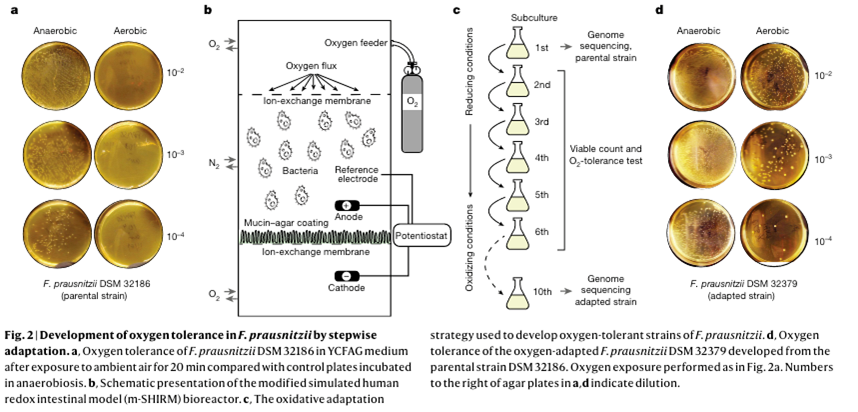
图2:分步骤的普拉氏栖粪杆菌的耐氧性调整策略
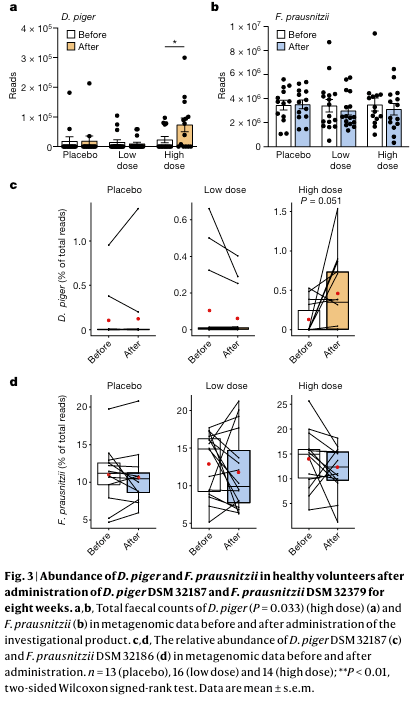 图3:接种了8周普拉氏栖粪杆菌DSM32379和猪脱硫弧菌DSM32187的健康志愿者体内的猪脱硫弧菌和普拉氏栖粪杆菌的丰度
图3:接种了8周普拉氏栖粪杆菌DSM32379和猪脱硫弧菌DSM32187的健康志愿者体内的猪脱硫弧菌和普拉氏栖粪杆菌的丰度
参考文献:
Khan, M.T., Dwibedi, C., Sundh, D. et al. Synergy and oxygen adaptation for development of next-generation probiotics. Nature (2023). https://doi.org/10.1038/s41586-023-06378-w
来源 | 食品加 智食科技

